Изучение механизмов иммунного ускользания опухоли показало, что рост, метастазирование и прогноз злокачественного новообразования зависят от функционирования иммунной системы пациента [1]. В настоящее время ведутся интенсивные работы по разработке и внедрению методов лечения, которые основаны на активации компонентов клеточного и гуморального противоопухолевого иммунитета. Одним из наиболее изученных и клинически эффективных методов является вакцинация с помощью дендритных клеток.
Дендритные клетки (ДК) — компонент клеточного звена врожденного иммунитета, выполняют антигенпрезентирующую и регуляторную функцию [2].
В организме человека ДК представлены гетерогенной популяцией, не имеющей одного общего антигенного маркера. Выделяют два основных типа ДК, которые в отечественной литературе называются миелоидными ДК (мДК) и плазмоцитоидными ДК (пДК), в зависимости от клетки-предшественницы (Рис. 1) [3].
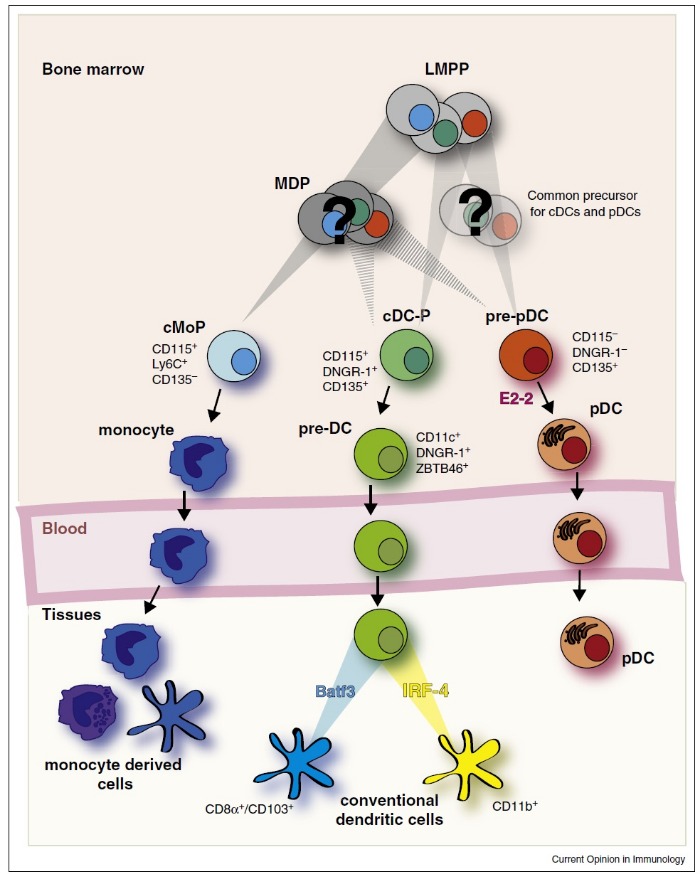
Рисунок 1 | Образование и дифференцировка подтипов ДК (подробности в тексте) [3].
MDP — общий предшественник клеток миелопоэза; LMPP — общий предшественник лимфопоэза; pDC — пДК; conventional dendritic cells — мДК; monocyte derived cells — ДК, дифференцирующиеся из моноцитов.
Большинство ДК образуются из клетки-предшественника миелопоэза и представляют собой мДК, поэтому в зарубежной литературе для них введено понятие «конвенциональные ДК» (conventional DC). Часть ДК образуются из клетки-предшественницы лимфопоэза — это пДК [3]. Кроме того, было показано, что моноциты при определенных условиях могут трансформироваться в дендритные клетки [4], а также неопределенной остается классификационное положение резидуальных тканевых моноцитов (например, клеток Лангханса) [2].
После завершения дифференцировки ДК покидают костный мозг и с током крови достигают периферических органов и лимфатических узлов [3]. По некоторым данным, период полужизни ДК составляет от 5 до 7 дней в селезенке, лимфатических узлах, печени и почках, но может достигать и 25 дней (например, в легких) [5,6].
В отсутствие специфических медиаторов воспаления, фрагментов микробных клеток или других активаторов, дендритные клетки находятся в «спящем» состоянии (толерогенная форма), что выражается в продукции ими иммуносупрессорных молекул и индукции Treg лимфоцитов. В случае попадания в межклеточную среду активаторов ДК превращаются в зрелую форму и модулируют компоненты врожденного и адаптивного иммунитета, а также выполняют антигенпрезентирующую функцию (Рис. 2). При этом ДК мигрируют с периферии в регионарные лимфатические узлы [7].
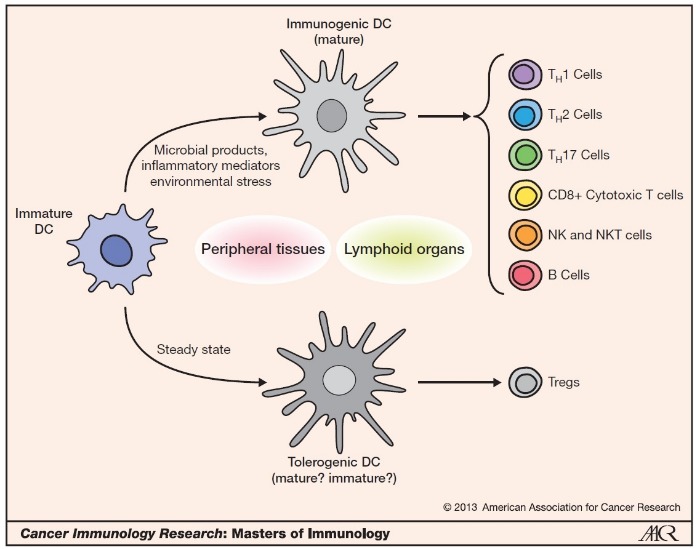
Рисунок 2 | Две основных формы существования дендритных клеток: «спящая»/толерогенная и активная/зрелая форма (пояснения в тексте).
Зрелые ДК могут иметь разнообразный набор антигенов, но важнейшим является наличие молекул главного комплекса гистосовместимости II класса (MHC-II), с помощью которых ДК могут активировать CD8+ и CD4+ лимфоциты, запуская адаптивный иммунный ответ. Для модуляции работы клеток иммунной системы на поверхности ДК имеются различные рецепторы и костимуляторы, представленные на рисунке 3.
Рисунок 3 | Основные рецепторы зрелой ДК.
CD86, CD80 — костимуляторы передачи сигнала Т-лимфоцитам;
CD40 — стимулирует продукцию ИЛ-12 и ИФН-γ Т-хелперами;
А — молекулы межклеточной адгезии;
TLR — toll-like рецепторы, необходимы для захвата антигенов;
К — рецепторы к компонентам комплемента;
Кроме стандартного для антигенпрезентирующих клеток (АПК) представления антигена через MHC-II, ДК способны встраивать захваченный антиген в MHC-I, напрямую активируя CD8+ лимфоциты [7].
Рисунок 4 | Взаимодействие ДК с Т-лимфоцитами. Комплексы антиген+MHC-I и MHC-II распознаются рецепторами Т-лимфоцитов (TCR), при этом ДК выделяет медиаторы, способствующие дифференцировки CD4+ клеток либо в Th1, либо в Th2.
ДК участвуют во всех типах специфических иммунных реакций, в том числе и в противоопухолевом иммунитете [8]. Способность активировать клеточное звено иммунитета и высокая эффективность передачи антигена позволяет выделить ДК среди других АПК в качестве потенциальной мишени для противоопухолевой терапии.
Терапия с использованием ДК получила название «вакцинация дендритными клетками». Суть метода заключается в создании искусственного активного специфического иммунитета в отношении опухоли, однако для большей эффективности вводятся не сами антигены злокачественных клеток, а индуцированные ДК [9]. При этом ДК не просто выполняют роль АПК, а еще и выделяют ряд цитокинов (ИЛ-12, ИЛ-6, ИФН-γ, ФНО-α), которые потенцируют пролиферацию и созревание иммунокомпетентных клеток [8, 9]. Протокол иммунотерапии ДК включает следующие этапы: забор ДК или их предшественников у пациента; индукцию их превращения в незрелые ДК; стимуляцию «созревания ДК»; введение клеток в организм пациента (Рис. 5) [9, 10]
Рисунок 5 |Этапы иммунотерапии с использованием ДК (подробности в тексте) [9].
Небольшое количество ДК можно получить непосредственным выделением из периферической крови пациента, однако их количество и фенотип могут быть неподходящими для эффективной иммунотерапии [11, 12]. Кроме того, ДК могут быть получены из клеток-предшественников, экспрессирующих CD34+, которые изолируют из костного мозга, периферической или пуповинной крови [13, 14]. Однако стандартным и наиболее эффективным методом является получение ДК из моноцитов периферической крови пациента, в связи с простотой метода и большим количеством получаемых клеток [9, 10]. Ряд исследований показал высокую эффективность ДК, полученных из моноцитов при иммунотерапии злокачественных опухолей [15–17].
Для превращения моноцитов в незрелые дендритные клетки их инкубируют со смесью цитокинов, которая содержит гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и один из цитокинов, ИЛ-4, ФНО-α или ИФН-α. ГМ-КСФ поддерживает пролиферацию и жизнеспособность клеток миелоидного ростка, а дополнительные цитокины способствуют дифференцировке в незрелые ДК. Незрелые ДК «нагружают» опухолевыми антигенами — инкубируют в среде, содержащей опухоль-специфичные пептиды, нуклеиновые кислоты, лизаты опухолевых клеток. В настоящее время вопрос оптимального варианта антигенной «нагрузки» ДК остается открытым. Активно изучается и показал хорошие результаты метод с использованием цельных опухолевых клеток и совместного культивирования ДК и опухоли [18, 19].После этого начинается «созревание» ДК. Этот этап необходим для экспрессии ДК рецепторов, необходимых для выполнения антигенпрезентирующей функции, кроме того, зрелые ДК начинают секретировать регуляторные цитокины. Для индукции созревания обычно используются различные комбинации ФНО-α с цитокинами, такими как ИЛ-1β, ИЛ-6, PGE2, ИЛ-18, интерфероны и лиганды TLR [9].
Зрелые ДК вводят в организм пациента внутрикожно, внутривенно, в лимфатические узлы или напрямую в опухолевый очаг [10].
Внедрение вакцин на основе ДК в клиническую практику началось в середине 90-х годов. Это были вакцины на основе ДК моноцитарного происхождения, культивированных со специфичными антигенами меланомы, такими как MART-1/Melan A и gp100 [20–22]. Кроме того, испытывались вакцины против В-клеточной лимфомы, миеломы, острого миелобластного лейкоза, рака предстательной железы и гепатоцеллюлярной карциномы (ГЦК) [20, 23–27]. Результаты исследований показали безопасность и иммуногенность вакцин на основе ДК. В случае ГЦК и меланомы удалось добиться активации CD8+-лимфоцитов не позднее 7 дня от начала терапии. В большинстве исследований принимали участие пациенты на поздних стадиях опухолевого процесса, однако у 10 % удалось добиться стойкой ремиссии заболевания. Кроме моноцитарных ДК, клинические испытания прошли вакцины на основе ДК, полученных из CD34+-клеток, а также плазмоцитоидные ДК. В обоих случаях вакцины обладали клинической эффективностью и были безопасны [28, 29].
В последнее время идет работа в области повышения эффективности доставки ДК в лимфатические узлы с помощью инъекций напрямую в лимфатические сосуды [30], а также в области сочетания вакцин из ДК и других вариантов иммунотерапии, например, блокады иммунологических контрольных «точек» (checkpoint blockade) [31].
Источники:
- Candeias SM, Gaipl US. The Immune System in Cancer Prevention, Development and Therapy. Anticancer Agents Med Chem. 2016;16(1):101-7.
- Liu K, Nussenzweig MC. Origin and development of dendritic cells. Immunol Rev. 2010;234(1):45-54.
- Schraml BU, Reis e sousa C. Defining dendritic cells. Curr Opin Immunol. 2015;32:13-20.
- Randolph GJ, Beaulieu S, Lebecque S, Steinman RM, Muller WA. Differentiation of monocytes into dendritic cells in a model of transendothelial trafficking. Science. 1998;282(5388):480-3.
- Ginhoux F, Liu K, Helft J, et al. The origin and development of nonlymphoid tissue CD103+ DCs. J Exp Med. 2009;206(13):3115-30.
- Liu K, Waskow C, Liu X, Yao K, Hoh J, Nussenzweig M. Origin of dendritic cells in peripheral lymphoid organs of mice. Nat Immunol. 2007;8(6):578-83.
- Mellman I. Dendritic cells: master regulators of the immune response. Cancer Immunol Res. 2013;1(3):145-9.
- Gardner A, Ruffell B. Dendritic Cells and Cancer Immunity. Trends Immunol. 2016;37(12):855-865.
- Santos PM, Butterfield LH. Dendritic Cell-Based Cancer Vaccines. J Immunol. 2018;200(2):443-449.
- Elster JD, Krishnadas DK, Lucas KG. Dendritic cell vaccines: A review of recent developments and their potential pediatric application. Hum Vaccin Immunother. 2016;12(9):2232-9.
- Nair S, Archer GE, Tedder TF. Isolation and generation of human dendritic cells. Curr Protoc Immunol. 2012;Chapter 7:Unit7.32.
- Alculumbre S, Pattarini L. Purification of Human Dendritic Cell Subsets from Peripheral Blood. Methods Mol Biol. 2016;1423:153-67.
- Smeland EB, Funderud S, Kvalheim G, et al. Isolation and characterization of human hematopoietic progenitor cells: an effective method for positive selection of CD34+ cells. Leukemia. 1992;6(8):845-52.
- Ueno H, Tcherepanova I, Reygrobellet O, et al. Dendritic cell subsets generated from CD34+ hematopoietic progenitors can be transfected with mRNA and induce antigen-specific cytotoxic T cell responses. J Immunol Methods. 2004;285(2):171-80.
- Kuhn S, Yang J, Ronchese F. Monocyte-Derived Dendritic Cells Are Essential for CD8(+) T Cell Activation and Antitumor Responses After Local Immunotherapy. Front Immunol. 2015;6:584.
- Vopenkova K, Mollova K, Buresova I, Michalek J. Complex evaluation of human monocyte-derived dendritic cells for cancer immunotherapy. J Cell Mol Med. 2012;16(11):2827-37.
- Butterfield LH. Dendritic cells in cancer immunotherapy clinical trials: are we making progress?. Front Immunol. 2013;4:454.
- Pinho, M. P., B. S. Sundarasetty, P. C. Bergami-Santos, K. Steponavicius-Cruz, A. K. Ferreira, R. Stripecke, and J. A. Barbuto. 2016. Dendritic-tumor cell hybrids induce tumor-specific immune responses more effectively than the simple mixture of dendritic and tumor cells. Cytotherapy 18: 570–580.
- Bonifaz, L. C., D. P. Bonnyay, A. Charalambous, D. I. Darguste, S. Fujii, H. Soares, M. K. Brimnes, B. Moltedo, T. M. Moran, and R. M. Steinman. 2004. In vivo targeting of antigens to maturing dendritic cells via the DEC-205 receptor improves T cell vaccination. J. Exp. Med. 199: 815–824.
- Butterfield, L. H., A. Ribas, V. B. Dissette, S. N. Amarnani, H. T. Vu, D. Oseguera, H. J. Wang, R. M. Elashoff, W. H. McBride, B. Mukherji, et al. 2003. Determinant spreading associated with clinical response in dendritic cellbased immunotherapy for malignant melanoma. Clin. Cancer Res. 9: 998–1008.
- Mukherji, B., N. G. Chakraborty, S. Yamasaki, T. Okino, H. Yamase, J. R. Sporn, S. K. Kurtzman, M. T. Ergin, J. Ozols, J. Meehan, et al. 1995. Induction of antigen-specific cytolytic T cells in situ in human melanoma by immunization with synthetic peptide-pulsed autologous antigen presenting cells. Proc. Natl. Acad. Sci. USA 92: 8078–8082.
- Nestle, F. O., S. Alijagic, M. Gilliet, Y. Sun, S. Grabbe, R. Dummer, G. Burg, and D. Schadendorf. 1998. Vaccination of melanoma patients with peptide- or tumor lysate-pulsed dendritic cells. Nat. Med. 4: 328–332.
- Hsu, F. J., C. Benike, F. Fagnoni, T. M. Liles, D. Czerwinski, B. Taidi, E. G. Engleman, and R. Levy. 1996. Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells. Nat. Med. 2: 52–58.
- Van Tendeloo, V. F., A. Van de Velde, A. Van Driessche, N. Cools, S. Anguille, K. Ladell, E. Gostick, K. Vermeulen, K. Pieters, G. Nijs, et al. 2010. Induction of complete and molecular remissions in acute myeloid leukemia by Wilms’ tumor 1 antigen-targeted dendritic cell vaccination. Proc. Natl. Acad. Sci. USA 107: 13824–13829.
- Rosenblatt, J., I. Avivi, B. Vasir, L. Uhl, N. C. Munshi, T. Katz, B. R. Dey, P. Somaiya, H. Mills, F. Campigotto, et al. 2013. Vaccination with dendritic cell/ tumor fusions following autologous stem cell transplant induces immunologic and clinical responses in multiple myeloma patients. Clin. Cancer Res. 19: 3640–3648.
- Kantoff, P. W., C. S. Higano, N. D. Shore, E. R. Berger, E. J. Small, D. F. Penson, C. H. Redfern, A. C. Ferrari, R. Dreicer, R. B. Sims, et al; IMPACT Study Investigators. 2010. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N. Engl. J. Med. 363: 411–422.
- Beer, T. M., G. T. Bernstein, J. M. Corman, L. M. Glode, S. J. Hall, W. L. Poll, P. F. Schellhammer, L. A. Jones, Y. Xu, J. W. Kylstra, and M. W. Frohlich. 2011. Randomized trial of autologous cellular immunotherapy with sipuleucel-T in androgen-dependent prostate cancer. Clin. Cancer Res. 17: 4558–4567.
- Paczesny, S., J. Banchereau, K. M. Wittkowski, G. Saracino, J. Fay, and A. K. Palucka. 2004. Expansion of melanoma-specific cytolytic CD8+ T cell precursors in patients with metastatic melanoma vaccinated with CD34+ progenitor-derived dendritic cells. J. Exp. Med. 199: 1503–1511.
- Benitez-Ribas, D., G. J. Adema, G. Winkels, I. S. Klasen, C. J. Punt, C. G. Figdor, and I. J. de Vries. 2006. Plasmacytoid dendritic cells of melanoma patients present exogenous proteins to CD4+ T cells after Fc gamma RII-mediated uptake. J. Exp. Med. 203: 1629–1635.
- Radomski, M., H. J. Zeh, H. D. Edington, J. F. Pingpank, L. H. Butterfield, T. L. Whiteside, E. Wieckowski, D. L. Bartlett, and P. Kalinski. 2016. Prolonged intralymphatic delivery of dendritic cells through implantable lymphatic ports in patients with advanced cancer. J. Immunother. Cancer 4: 24.
- Wilgenhof, S., J. Corthals, C. Heirman, N. van Baren, S. Lucas, P. Kvistborg, K. Thielemans, and B. Neyns. 2016. Phase II study of autologous monocyte-derived mRNA electroporated dendritic cells (TriMixDC-MEL) plus ipilimumab in patients with pretreated advanced melanoma. J. Clin. Oncol. 34: 1330–1338.